
或掃碼獲取報告

? 腫瘤的復發:微小殘留病灶MRD。在腫瘤患者接受治療后,盡管從影像學上似乎徹底清除了病灶,但仍有極少量未被檢測到的腫瘤細胞殘存或腫瘤細胞來源分子異常。這些殘存的腫瘤病灶被稱之為微小殘留病灶(Minimal Residual Disease,MRD)或分子殘存病灶(Molecular Residual Disease)。MRD具有與原始腫瘤細胞相同或相似的表型和遺傳特征,可能仍擁有導致腫瘤復發的能力。
? 對MRD的檢測:基于腫瘤的生物學和生理特征,腫瘤組織在代謝和增殖等生理過程中向循環系統釋放許多細胞或分子。用于血液瘤MRD檢測的主要生物標志物是循環腫瘤細胞(Circulating Tumor Cells,CTC)。對于實體瘤,其通常將循環腫瘤細胞(CTC)和循環腫瘤DNA(circulating tumor DNA,ctDNA)釋放到體液中,但由于早期實體瘤很少釋放CTC到循環系統中,而ctDNA在所有階段的腫瘤中都會持續釋放,并且與腫瘤動力學高度相關,因此是目前用于實體瘤MRD檢測的主要標志物。
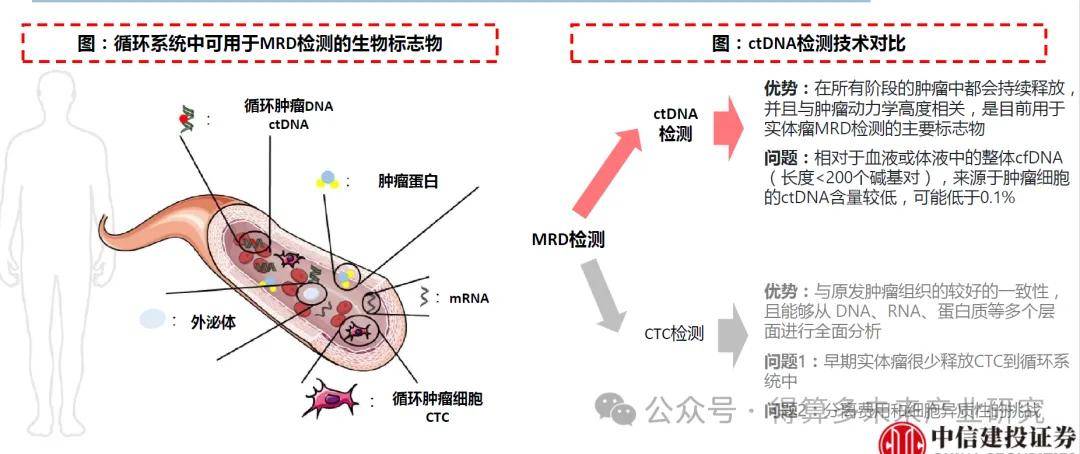
? 基于癌癥特異性突變檢測ctDNA。ctDNA可以根據各種基因組特征進行檢測,包括癌癥特異性突變(cancer specific mutations)、甲基化、拷貝數變異(CNV)或ctDNA的其他特征等。癌癥特異性突變檢測是最常用于檢測ctDNA的基因組特征。
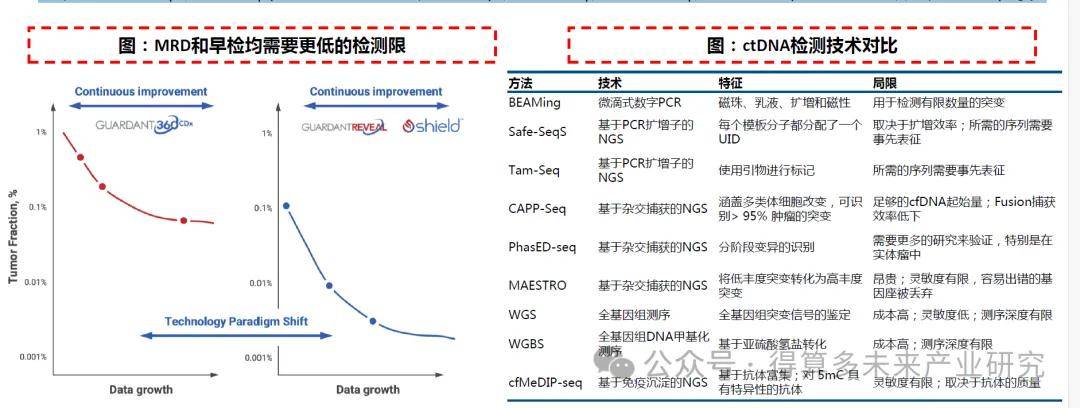
? NGS+定向檢測:靈敏度和廣度的平衡。由于此前提到的在血液或體液整體cfDNA中,腫瘤相關ctDNA含量較低,因此使得癌癥特異性突變的頻率通常較低。最初基于ddPCR的方法BEAMing實現了較好的靈敏度,但可檢測突變數量十分有限。基于NGS的方法可以對患者樣本的大量DNA模板進行高通量測序,但靈敏度較低,由于NGS錯誤率導致罕見突變難以被檢測。因此將NGS與定向的檢測方法相結合能夠對ctDNA中的大量突變進行多重檢測,在保證廣度的同時也盡可能的提高了NGS檢測的靈敏度。近年來已被開發的技術包括Safe-SeqS、Tam-Seq(基于PCR擴增子的靶向NGS)、CAPP-Seq、PhasED-seq、MAESTRO(基于雜交捕獲的靶向NGS)等。
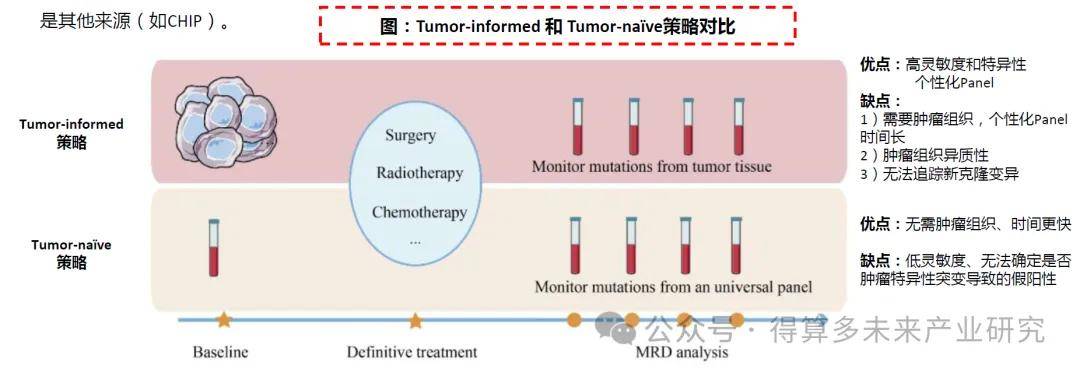
? Tumor-informed可能是更優策略。目前基于ctDNA進行MRD分析有兩種策略:Tumor-informed(依賴腫瘤組織信息)和Tumor-na?ve(與腫瘤類型無關的固定Panel)。
? Tumor-informed策略:對患者原發腫瘤組織進行WES測序,鑒定患者的特異基因組變異,定制化篩選、設計監測Panel進行個性化的ctDNA檢測分析。該策略可實現較高的靈敏度和特異性,個性化Panel可獲取患者攜帶的特有變異。但該方法需要足夠的腫瘤組織。此外,腫瘤中存在異質性,因此Tumor-informed方法可能會由于組織樣本偏差而錯過一些突變。Tumor-informed分析也無法追蹤隨訪期間出現的新克隆變異。
? Tumor-na?ve策略:固定化Panel,也稱Tumor-agnostic,通過預先選定的引物/探針設計與癌癥類型相關的panel,檢測ctDNA突變或甲基化等特征。該方法優點為無須原發腫瘤組織,時間更快。缺點包括靈敏度可能較低,以及無法確定突變是否為腫瘤特異性還是其他來源(如CHIP)。
Natera:MRD產品適應癥持續拓展并獲醫保納入
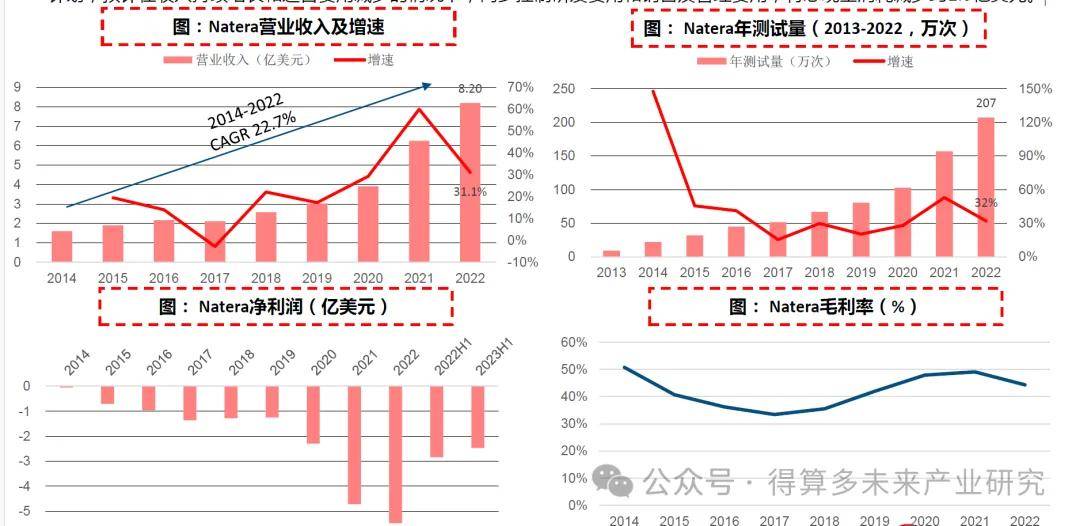
基于cfDNA檢測開發系列產品。Natera成立于2004年,結合分子生物學技術和生物信息學分析打造了cfDNA技術平臺,并開發了系列產品,公司發展初期依靠無創產前檢測NIPT業務起步作為核心業務,此后在MRD和移植監測領域持續發力,2017年推出高精度和個性化MRD檢測產品Signatera,2019年推出Prospera腎移植評估測試,同時快速推進臨床研發、擴大病種應用。2015年公司在納斯達克上市,2022年公司營收8.20億美元。
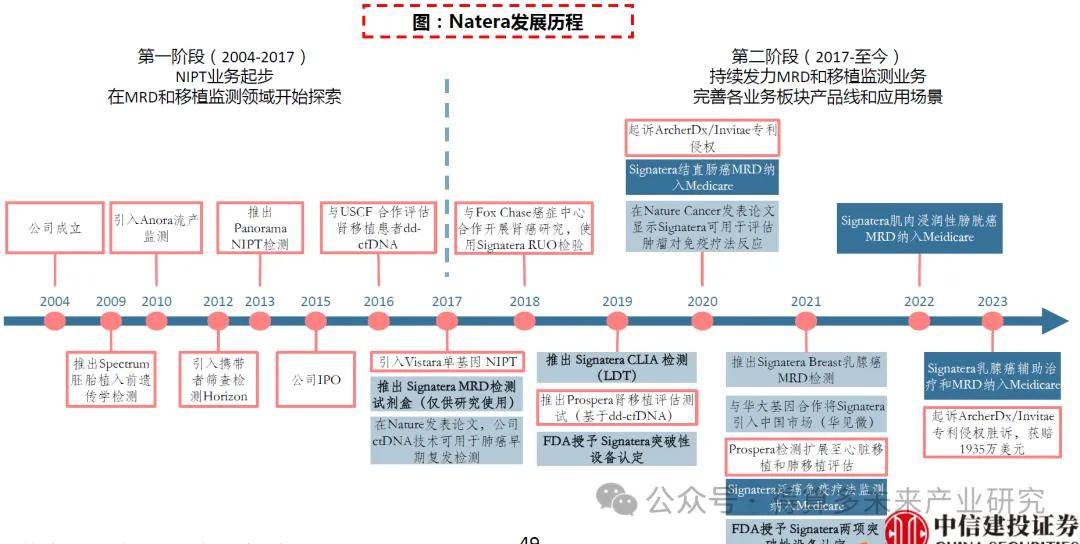
測試量不斷提升,營收保持高增長。公司在過去十年不斷豐富三大業務線產品,推動測試量增長,2022年公司年測試量已突破200萬次。受測試量驅動公司營收快速增長,2022年營收8.2億美元,2014-2022營收CAGR達22.7%。2017年之后隨著MRD和器官移植業務發展,毛利率從30%回升至50%左右。目前公司仍處于虧損狀態,但虧損趨勢已有縮窄,2023年公司發布全年控費計劃,預計在收入持續增長和運營費用減少的情況下,同步控制研發費用和銷售及管理費用,將總現金消耗減少約1.5億美元。
Signatera:Tumor-informed策略MRD檢測代表產品
Signatera?:Tumor-informed策略MRD檢測。2017年,公司推出Signatera RUO版本,基于ctDNA提供高靈敏度和個體化的MRD檢測,當時僅限癌癥研究人員和生物制藥公司用于研究使用;2019年,公司商業化發布Signatera,可在CLIA和CAP認證實驗室以LDT方式使用。2019到2021年Signatera獲得FDA授予3項突破性設備認定。
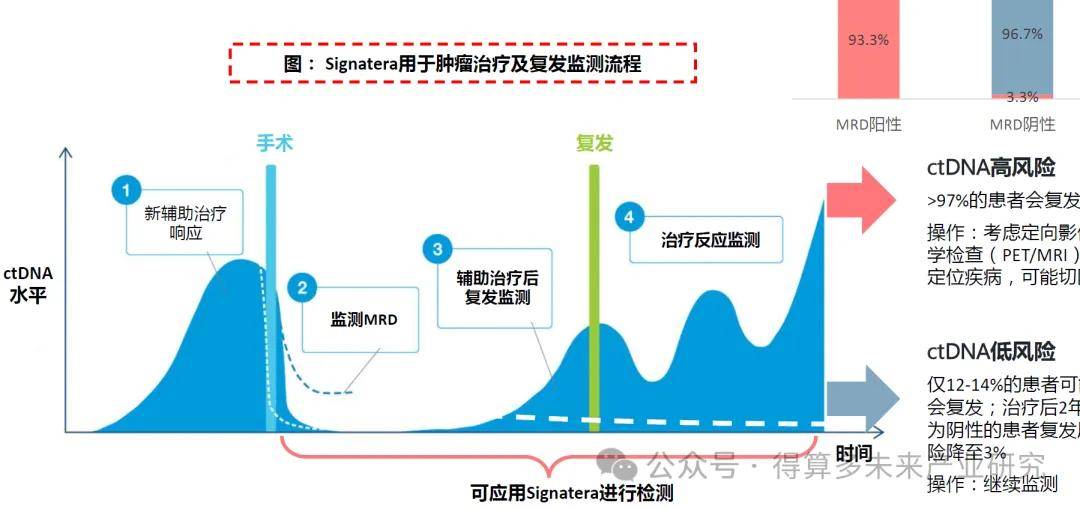
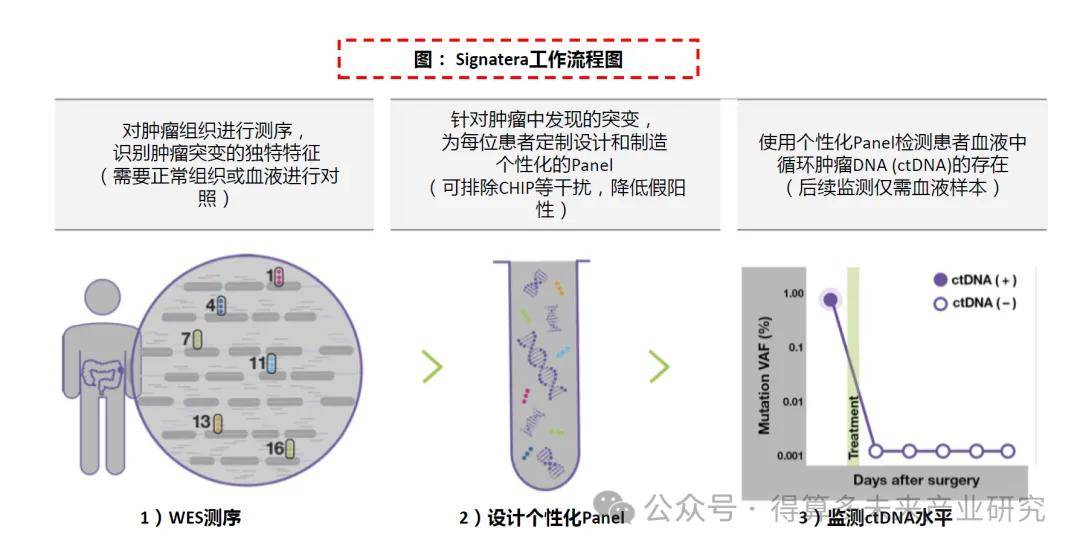
“WES+個性化Panel”,監測突變數量和靈敏度占優:Signatera采用“Tumor-informed”策略,通過每個患者組織樣本WES檢測結果與正常組織或血液進行對照,設計定制后續追蹤突變位點的個體化Panel進行監測,報告是否檢測到循環腫瘤DNA(ctDNA),并為縱向評估提供每毫升平均腫瘤分子數(MTM/mL),可監測的突變數量多、靈敏度高。
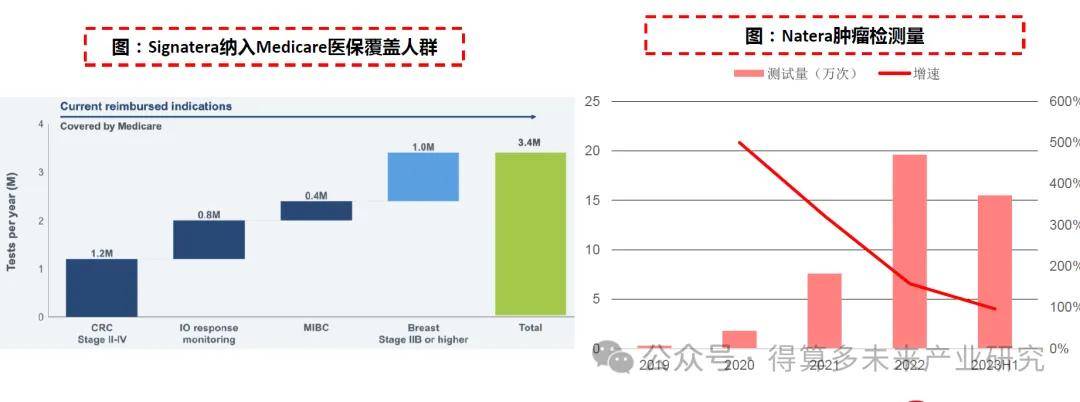
? 適應癥持續擴展并被納入Medicare。自推出以來Signatera的適應癥范圍持續拓展,且相繼被Medicare納入醫保報銷范圍。目前Medicare覆蓋范圍已經包括了II、III期結直腸癌MRD監測(2020年納入)、泛癌免疫治療療效監測(2021年納入) 、肌肉浸潤性膀胱癌MRD監測(2022年納入)和IIB期及以上乳腺癌MRD監測(2023年納入)四大方向。醫保納入擴展產品應用的市場空間,目前Signatera針對Ⅱ-Ⅳ期結直腸癌、泛癌免疫治療療效監測、肌肉浸潤性膀胱癌、IIB期及以上乳腺癌監測可覆蓋的Medicare報銷人群分別為120萬、80萬、40萬和100萬,總人群達340萬。
? 腫瘤檢測業務快速放量:根據公司披露,截至目前已有超過30%的美國腫瘤專家訂購Signatera,新客戶數量持續增長,2022年腫瘤檢測量達19.6萬次,2023年上半年已超15萬次,在各項腫瘤MRD的使用率均有上升。
積極推進臨床試驗,數據支撐醫保納入。CMS的Palmetto MolDX項目在建議將某項檢測納入醫保之前通常會先公布LCD(localcoverage determination),可以看到LCD會突出已發表的文章情況,例如將Signatera檢測結直腸癌MRD納入醫保時,MRD結果的高靈敏度,以及和無復發生存期的相關性被著重強調。目前,公司Signatera產品已在結直腸癌、乳腺癌、肺癌、卵巢癌、膀胱癌、多發性骨髓瘤、食管癌等十余種癌癥開展臨床試驗并獲得陽性結果,預測癌癥復發的整體敏感性在88%-100%,特異性在98%-100%。醫保覆蓋工作有望持續推進。

未來展望:癌種持續拓展,臨床數據讀出推動指南納入和醫保覆蓋
癌種持續拓展,推動指南納入。目前,公司Signatera產品已在結直腸癌、乳腺癌、肺癌、卵巢癌、膀胱癌、多發性骨髓瘤、食管癌等十余種癌癥開展臨床試驗,預測癌癥復發的整體敏感性在88%-100%,特異性在98%-100%。部分已被納入報銷范圍的癌種如結直腸癌和乳腺癌,對于不同亞型及不同試驗類型的臨床也正陸續開展,通過多項前瞻性和RCT試驗進一步獲取臨床證據,有望推動指南納入和醫保覆蓋。
